|
细胞信号转导动力学研究的最新成果(pdf下载)
本课题组在细胞肿瘤抑制机制的动力学及其调控方面取得重要成果,揭示出多条信号通路如何动态协作,确保细胞对促癌信号的监测和恰当响应。论文“Modeling
the response of a
tumor-suppressive network to
mitogenic and oncogenic
signals”于2017年5月8日在美国科学院院报PNAS在线发表(http://dx.doi.org/10.1073/pnas.1702412114)。该工作是本课题组与美国Rice大学J.N.
Onuchic教授等同行的合作成果,研究生田欣瑜、黄博为论文共同第一作者,刘锋教授、Onuchic教授和王炜教授为共同通讯作者。
结合基因表达调控和信号转导来研究细胞的应激反应既是细胞生物学的前沿课题,也是多学科交叉的热点课题。限于当前的实验技术条件,从单细胞水平阐明这些反应的分子机制仍然是巨大的挑战。即使能做到单细胞水平的测量,往往也只能给出某些时间点上的测量数据,而生物反应过程本身却是动态变化的。因此,建立相关生物过程的动态分子网络模型,模拟计算并刻画其动力学,从而揭示其调控机制,是重要的创新研究方式。采用这样的定量计算系统生物学研究方法,本课题组在细胞如何应答DNA损伤、低氧、端粒缩短等方面已经做出了系列创新工作(如PNAS,106,12245
(2009);PNAS, 108, 8990
(2011)等文章)。最近,我们提出新的模型,在细胞肿瘤抑制的动力学和调控机制方面取得重要进展。
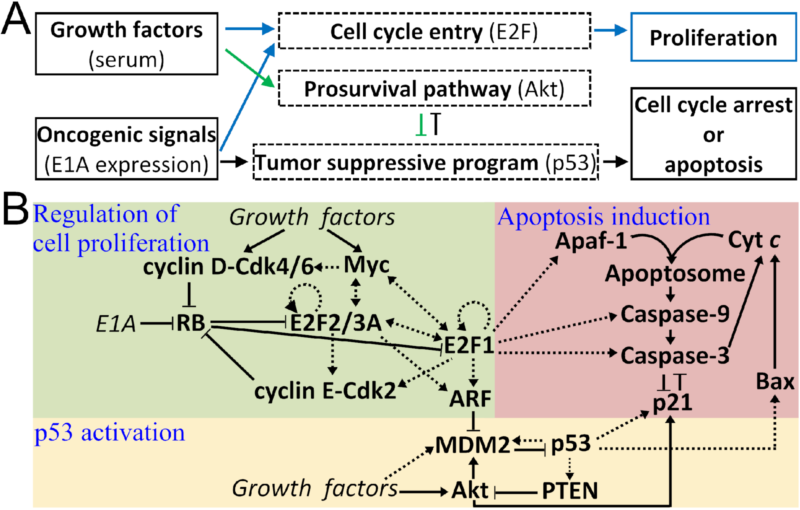
图1:细胞肿瘤抑制网络图。A)网络中的信号流;B)含3个模块的网络构成。
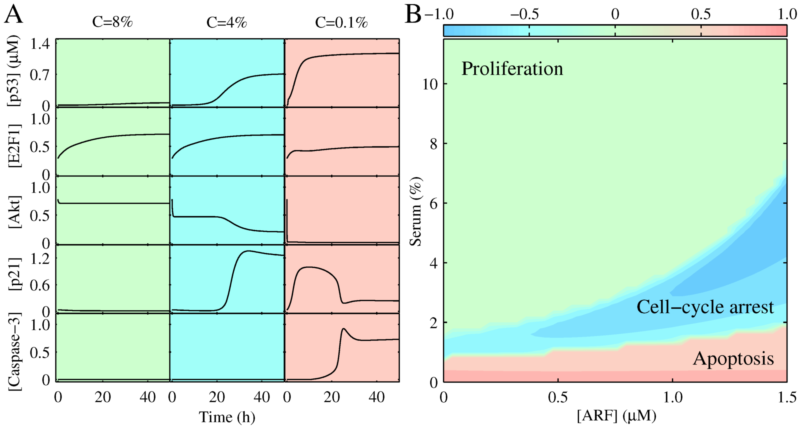
图2:信号分子动力学和细胞命运抉择。A)关键信号分子在不同血清浓度下的动力学; B)3种细胞命运的分布相图。
正常细胞含有一套精准的肿瘤抑制机制,能够识别癌信号,并通过诱导细胞周期阻断或凋亡来抑制细胞的异常增殖。尽管人们对肿瘤抑制网络的信号通路有了较明确的认识,但对其运作机制还了解甚少。其中一个基本的问题是,在异常促增殖信号(如源于E1A癌蛋白过表达)和生长因子(促细胞增殖)共同作用下,细胞是如何应答的?为此,我们构建了含有三个模块的信号转导分子网络模型,分别描述细胞周期进程调控、p53活化和细胞凋亡等过程(如图1所示),开展数值模拟,刻画了网络对生长因子和E1A癌蛋白的响应特性。结合刻画网络的动力学,得到了一系列重要结果:1)发现网络通过ARF蛋白的“全或无”表达来区分正常和异常的促增殖信号;2)揭示了网络中重要信号分子,如p53、E2F1、Akt、p21、caspase-3等在不同情形下的动力学和功能(图2A);3)阐明了细胞命运抉择的分子机制,揭示了细胞增殖、细胞周期阻断、凋亡等不同命运对促存活和促凋亡信号强度的依赖关系(图2B);4)发现了细胞凋亡的诱导经历可逆转到不可逆转的过程,并结合细胞色素c释放和caspase-3活化的两相动力学给出了解释。这些结果给出了细胞肿瘤抑制过程的动态信号处理图像,以及蛋白质动力学对网络抑癌功能的调控机制。该工作对人们了解细胞的肿瘤抑制机制具有重要的科学意义,为恢复和调控肿瘤细胞的肿瘤抑制功能的应用研究提供了重要线索。
该工作得到国家自然科学基金、科技部973计划等项目和人工微结构科学与技术协同创新中心的支持。
(2017.5)
蛋白质天然态结构物理特性研究最新成果(pdf下载)
本课题组在蛋白质分子体系天然态结构涨落的物理特性方面研究取得重要成果,揭示出自然选择的蛋白质具有临界物理特征,可有效实现其结构稳定性和灵活性之间的平衡。论文“Critical
fluctuations in the native state
of
proteins”于2017年2月24日在物理学评论快报在线发表(Phys.Rev.Lett.,118,
088102(2017)),该工作是本课题组与阿根廷圣马丁大学的D.R.Chialvo教授合作成果,博士生唐乾元同学为论文第一作者,王骏教授、王炜教授和Chialvo教授为共同通讯作者。
蛋白质是生物系统的结构组成和生命过程最基本的生物大分子,其天然态结构是生物体系的组成稳定性和功能执行之基础。1970年代以来,基于诺贝尔奖获得者安芬森的蛋白质折叠可逆性,人们建立了以天然结构稳定性为核心的蛋白理论框架。理解蛋白质分子的序列、结构与功能之间的关系成为分子生物学研究的核心,是物理学与生物学交叉的前沿方向。近年来,人们在蛋白质柔性和功能运动方面积累了越来越多的认识,对蛋白质天然态结构的科学内涵提出新的挑战。如何刻画蛋白质结构稳定性与功能运动的动态关系,揭示相关的普适物理特性?这些基础性研究将极大地提升人们对蛋白质分子体系物理特性的认识及其生物功能的了解。
本研究工作从蛋白质功能运动的物理过程出发指出:一方面,蛋白质分子必须具有一定柔性且足够敏感,才能保证其在细胞环境中捕捉和感受各种信号,从而发生构象变化和行使生物功能;另一方面,如果分子柔性过大,在环境扰动影响下,其结构会变得很不稳定,从而影响其功能的实现。围绕这种竞争和平衡,我们运用统计物理,对蛋白质结构数据库中相关的蛋白质分子结构集合进行统计分析,发现蛋白质分子中氨基酸之间的位置涨落存在长程关联,关联长度与蛋白质尺度大小相当,标度后的关联函数展示出普适行为(图1a-d)。结果表明,不管蛋白质分子大小如何,分子中某一氨基酸残基的运动,会被分子内其他氨基酸残基感受到。还发现蛋白质分子在特定形状因子附近的涨落特性具有临界标度行为(图2a),更多的蛋白质分子具有更大的涨落或更大的“可变性”。这些特征与统计物理学中相变的“临界现象”非常相似,蛋白质分子的天然态结构正是在“有序”和“无序”之间达到了其“临界点”。揭示在自然进化和选择过程中,蛋白质分子需要在结构的“稳定性”和“可变性”之间达成某种平衡,这种竞争和平衡在蛋白质结构和功能层面上对应着相关的临界特性,从而展现出蛋白质分子的共有结构特征(图2b)。
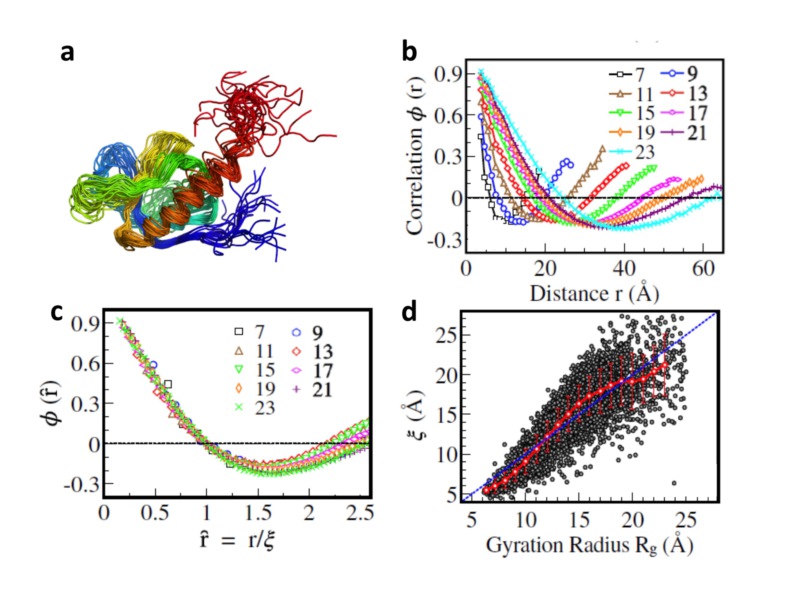
图1:(a)蛋白质分子结构涨落(示意图);(b)不同大小蛋白质的相关函数;(c)标度后完全重合,展示蛋白质结构涨落的普适特征;(d)关联长度与蛋白质尺寸大小的关系。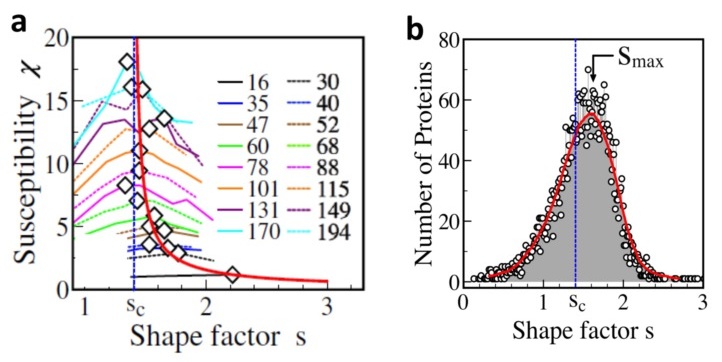
图2:(a)不同大小蛋白质的可变性(或敏感性)和形状因子之间的关系,表现出类似“临界行为”的特征,揭示了蛋白质结构涨落的基本物理特点。(b)自然界的蛋白质分子倾向出现在临界性最强的形状因子附近。
该项工作通过对蛋白质结构数据的统计分析和相关物理特性的刻画研究,在结构生物学实验和理论与统计物理学理论之间架起了桥梁,为人们揭示生物分子进化的原理提供了新思路,对理解蛋白质的折叠、变构和聚集等动力学过程具有重要的理论意义。“临界性”本身为蛋白质设计提供理论基础,可为药物和抗体的设计等问题提供新的启示和参考。该项工作推进了人们对蛋白质分子体系结构和功能的认识。研究项目得到国家自然科学基金和科技部973计划等项目的支持,以及人工微结构科学与技
术协同创新中心的支持。
(2017.3)
蛋白质折叠动力学研究取得突破性进展(pdf下载)
本课题组在解决困扰学界多年二硫键形成与折叠关系难题方面的研究取得突破性进展。论文“Protein
folding guides disulfide bond
formation”于2015年8月22日在美国科学院院刊在线发表(PNAS,
2015,
DOI:10.1073/pnas.1503909112),该项工作是王炜教授课题组与马里兰大学物理科学与技术研究所Dave
Thirumalai教授的合作成果,论文第一作者是物理学院秦猛副教授。
生命体功能基本是由正确折叠的蛋白质来执行,蛋白质的错误折叠不仅会使其失去原有生物学功能,也会引起一系列重大疾病,如疯牛病、老年痴呆症等。上世纪60年代,美国NIH著名科学家Anfinsen在其获诺贝尔奖工作中通过对含有二硫键蛋白质牛胰核糖核酸酶的再折叠实验研究,提出了蛋白质折叠的Anfinsen法则,即去折叠的蛋白质在体外可自发进行再折叠,决定其最终折叠结构的信息包含在蛋白质氨基酸序列之中。在含硫键蛋白质的折叠过程中,其关键环节就是二硫键的正确形成。近50年来,实验研究一直在争论到底二硫键的形成促进了蛋白质折叠,还是蛋白质折叠导致了二硫键的正确形成。正确理解二硫键形成在蛋白质折叠过程中的作用,对揭示蛋白质折叠和错误折叠的物理机制,以及寻找相关重大疾病发生的致病机理具有重要的科学意义,是相关研究领域的前沿和难点。
我们通过近年来的不懈努力,首次提出了蛋白质折叠过程中二硫键氧化和还原反应发生的物理模型,模拟了牛胰蛋白酶抑制剂(BPTI)的折叠过程,揭示了其氧化折叠的物理机制(如图1所示)。研究结果阐明了含二硫键蛋白质的折叠动力学过程中,由序列特征所决定的构象早期形成将有效促进二硫键的形成,诠释了数十年来学界期望解决的二硫键在蛋白质折叠过程中的作用。模拟中所展示的蛋白质折叠微观动力学过程,清楚地描述了BPTI折叠早期所形成的b-发卡结构可有效促进二硫键[14-38]的形成,进而诱导其他二硫键的形成。特别是,研究结果还定量刻画了折叠限速中间体N*(含有2对正确折叠的二硫键5-55,14-38,如图1所示)以及最后一对正确二硫键(14-38)形成过程中所经历的非天然态二硫键中间体状态。
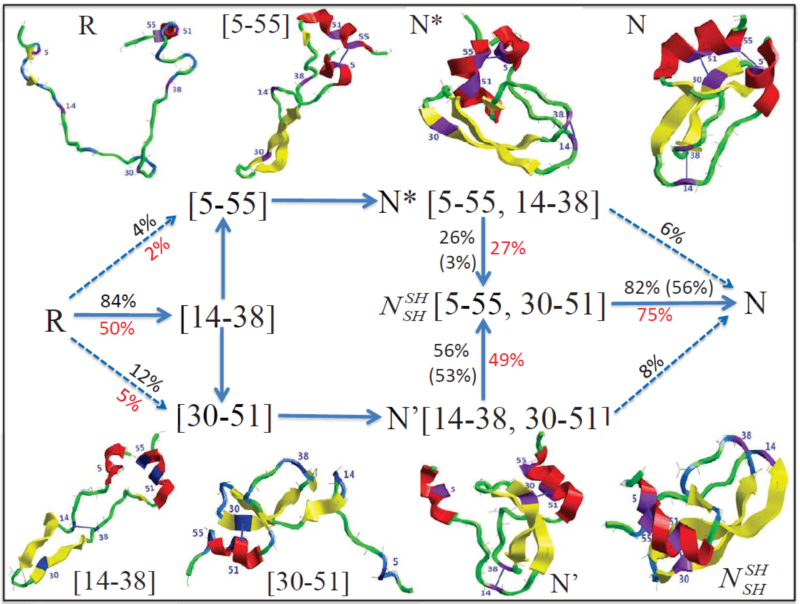
图1:蛋白质BPTI折叠路径由多个含有不同二硫键折叠中间体组成,刻画了从完全去折叠态R(二硫键全部被还原)到折叠态N(含3对正确形成的二硫键)的折叠全过程。折叠过程中所经历的关键折叠中间体、不同氧化还原环境下的折叠行为(例如通量百分比)等均被定量描述。
本工作中提出的物理模型和研究方法对探索富含二硫键蛋白质折叠提供了通用和有效的手段,是蛋白质折叠动力学和功能相关动力学研究领域的重要进展,对进一步研究蛋白质错误折叠的发生以及探讨相关重大疾病致病的分子机理提供了重要理论基础。论文网络版刊出后随即被美国科学网站phys.org专文报道(http://phys.org/news/2015-08-simulation-reveal-role-disulfide-bonds.html)。该工作得到了国家自然科学基金(11374148,11334004)和科技部973项目(2013CB834100)支持。
力调控蛋白质分子功能研究进展(pdf下载)
本课题组在力调控蛋白质分子与配体结合及其功能方面的研究取得重要进展,研究论文“Single
molecule force spectroscopy
reveals force-enhanced binding
of calcium ions by gelsolin ”
于2014 年8 月7 日在《自然-通讯》( Nature
Communications)上在线发表(doi:10.1038/ncomms5623),论文共同第一作者包括博士生吕春梅和高翔,通讯作者是物理学院曹毅教授、王炜教授以及新加坡IMCB
的Robert Robinson
教授,后者提供了有关蛋白的基因质粒。该项工作得到国家自然科学基金和科技部973计划支持。
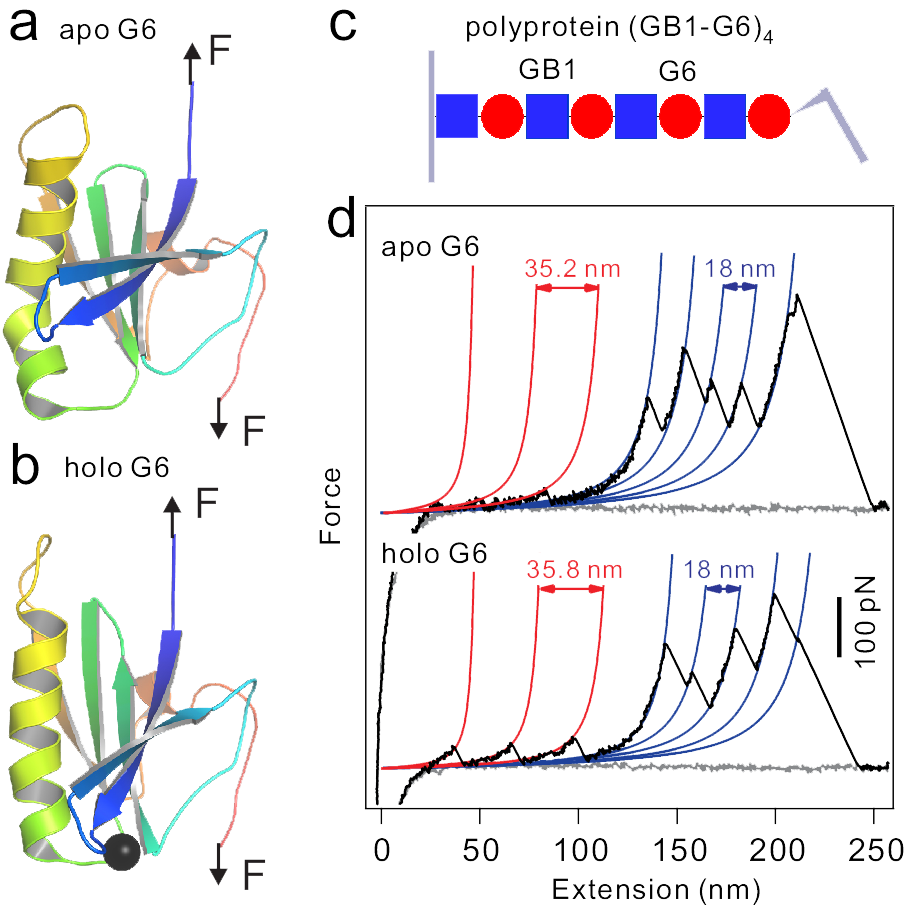
细胞骨架是细胞三大系统之一,在维持细胞形貌、承受外力和保持细胞内部结构的有序以及细胞运动,物质运输,能量转换,信息传递和细胞分裂等方面起着重要作用。凝溶胶蛋白(gelsolin)是调控细胞骨架肌动蛋白微丝结构的重要蛋白分子,对肌动蛋白微丝进行剪切和封盖。钙离子的结合可以改变凝溶胶蛋白亚基的构象,使整个凝溶胶蛋白从球状结构变成珍珠项链状线性结构,从而调控其活化和功能。然而生化实验发现凝溶胶蛋白与钙离子的解离常数仅在数百微摩尔量级,远远高于数十微摩尔左右的正常生理钙离子浓度。这就使得凝溶胶蛋白的活化机制很难基于现有的生化实验数据来解释。这一难题一直困扰着相关领域的科学家,是细胞骨架研究中的一个重要基础问题。
本课题组发展了一种测量蛋白与配体结合的新型实验方法,通过原子力显微镜测量单根凝溶胶蛋白分子在不同钙离子浓度下的解折叠力,研究其在受力下与钙离子的结合强度。实验结果表明,施加在凝溶胶蛋白分子两端的外力导致其与钙离子的结合强度指数增加,10
皮牛左右外力可提高5.5
倍结合强度。在生理条件下,不同亚基间的相对运动会使得凝溶胶蛋白内部有着较大的张力,从而使得其可以在较低钙离子浓度下活化,
通过对照实验揭示了这一机制。这一发现很好地解释了凝溶胶蛋白活化的机理,解决了困扰人们多年的难题。此外,这些实验结果也丰富了人们对外力调控蛋白质与配体结合的新认识。通常情况下,外力可改变蛋白天然态的构象,降低蛋白与配体的结合,甚至引起蛋白质的解折叠。但该项实验研究却表明在某些条件下,适当的外力却可以“帮助”蛋白质与配体的结合。分子动力学理论模拟表明这一效应是通过改变凝溶胶蛋白钙离子结合位点的构象来实现的。
尽管人们已观测到力可改变生物过程这一现象,但其分子机制却一直不甚明晰。该项研究以凝溶胶蛋白为例揭示了由离子配位导致蛋白不同亚基构象和张力的变化,刻画了力调控蛋白分子功能的分子机制,证实了力是非常重要的生物信号。这一发现将促进人们对许多复杂生物过程的认识,从力的角度定量刻画蛋白的功能运动和信号过程。

(2014.8)
蛋白质分子功能运动研究取得重要进展(pdf下载)
本课题组在蛋白质分子功能运动理论研究方面取得重要进展,研究论文“Energy
landscape views for interplay
among folding, binding, and
allostery of calmodulin
domains”于2014
年7月7日在线发表于《美国科学院院刊》(PNAS, 2014,
111,
DOI:10.1073/pnas.1402768111)上,论文第一作者是李文飞教授。该项研究是与日本京都大学Shoji
Takada
教授合作,并得到国家自然科学基金和江苏省自然科学基金支持。
蛋白质分子是生命系统行使生物学功能最主要的生物大分子。在行使功能过程中,有一大类“别构蛋白”在辅助因子(如金属离子、ATP
分子等)帮助下,在两个功能状态之间反复做开关运动。与只有单个功能结构的“简单蛋白”相比,这类别构蛋白序列所编码的氨基酸水平物理相互作用网络和蛋白结构展现出特殊复杂性,需同时满足如下要求:
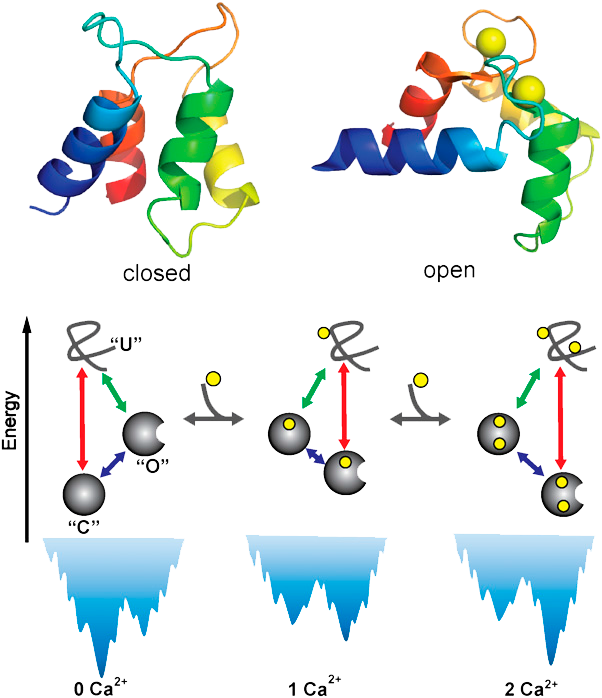
1)具有漏斗形能量面,以保证其正确折叠;2)两个功能状态之间的能垒尽量低,以实现高效率的功能运动和别构信号的跨尺度传递;3)能够有效地结合辅助因子。别构蛋白如何协调上述三个方面要求,从而同时实现正确的折叠、高效的别构运动和精准的辅助因子结合,以及这类别构蛋白如何组装和调控下游蛋白功能运动的研究,是相关生物物理、生物化学、医学等多学科普遍关心的前沿课题之一。钙调蛋白(calmodulin)是典型的别构蛋白,通过与钙离子的结合,在一系列信号调控和传导过程(如细胞凋亡、肌肉收缩和神经信号传导等)中起重要作用,其研究一直是相关领域的热点课题。
我们在统计物理学和能量面理论框架下,针对钙调蛋白,建立了一个能够统一描述蛋白质折叠、别构运动以及辅助因子结合的理论模型。该模型有效整合了蛋白质折叠的最小阻挫原理以及该小组前期工作中发现的蛋白质序列设计的别构特征,并基于多尺度策略描述了由辅助因子所引入的局域相互作用与蛋白质大尺度构象运动的跨尺度相互作用网络特征,以及辅助因子对能量面的重塑效应。通过模拟计算,首次在统一的理论模型框架下实现了对钙调蛋白折叠、别构运动和辅助因子结合过程的整合描述,并揭示出上述三个动力学过程相互耦合和协调运作的微观物理机制。特别
地,发现了自然界蛋白质高效率别构运动的要求会显著降低折叠能量面的优化程度,从而对折叠动力学引入阻挫。辅助因子的引入能够显著改变别构蛋白的折叠机制:在低辅助因子浓度下,别构蛋白的折叠以“自发折叠”机制为主;随着辅助因子浓度的增加,别构蛋白的折叠机制转化为“诱导折叠机制”。
以上研究成果对揭示分子层次上生物系统实现生物功能的基本物理原则和信号传导机制具有重要意义,并可为寻找基因/蛋白质缺陷相关疾病的有效治疗途径提供参考。
(2014.7)
DNA损伤响应中p53动力学的两阶段性(pdf下载)
最近,本课题组在肿瘤抑制蛋白p53动力学研究方面取得重要进展,
研究成果“Two-phase dynamics of p53
in the DNA damage
response”已被《美国科学院院刊》(PNAS)在线发表。
当机体受到来自外界的应激刺激而产生DNA损伤时,细胞会通过一系列动力学过程对损伤做出响应,从而避免机体组织发生癌症等病变的危险。在这一过程中,肿瘤抑制蛋白p53发挥着核心的作用。DNA损伤响应过程中的p53动力学及其功能是近年来癌症研究领域的热点。以前认为,p53的水平会随着损伤的增强呈现阶梯式的增加,进而指导细胞走向不同的命运,即低强度损伤引起掉低水平的p53积累并促进细胞的存活,高强度损伤导致p53大量积累,进而引起细胞的程序性死亡。然而,在细胞内随机环境下,这种阶梯式的响应机制鲁棒性较差,因为随机涨落可能导致细胞的过度死亡。近年来,研究发现细胞内p53水平会呈现出一系列的脉冲,脉冲的数目和损伤强度之间存在正关联。因而,细胞的命运可能是由p53脉冲的数目决定的。由p53脉冲数目来决定细胞命运具有比较好的鲁棒性,但这种机制在执行细胞凋亡方面效率较低,因为即使细胞凋亡的决定作出后,还需经过较长时间细胞才能被杀死。因此,亟需一种既具有鲁棒性又具备高效性的p53调控的细胞命运抉择机制。
本课题组构建了一个p53对DNA损伤响应的动力学模型,该模型整合了DNA损伤修复、损伤感知、p53动力学调控和细胞命运抉择模块。我们提出细胞内p53动力学受p53蛋白水平和后翻译修饰状态共同调控,呈现一种渐进激活的行为。在响应早期阶段,p53被初步磷酸化,p53相关的负反馈会引发一系列p53脉冲,此时细胞周期被阻断。如果损伤在p53脉冲数目达到某个阈值之前成功修复,则细胞可以回到正常生长状态。另一方面,如果损伤很严重,在p53脉冲数目达到阈值后人不能完成修复,则p53蛋白会被进一步修饰,相关正反馈会占据主导,导致p53蛋白水平上升到一个更高的稳态,高水平的p53则通过凋亡的方式迅速杀死严重损伤的细胞。
该理论模型提供了一种最优化的p53调控细胞命运抉择的动力学机制,这种机制集合了以往p53阶梯响应和脉冲式响应的优势。该研究的理论结果可以很好地解释已有实验结果,并为进一步的实验研究提供了很好的理论预言。这一研究有助于人们进一步了解p53实现其肿瘤抑制功能的内在机制。

(2011.4)
P53脉冲数目决定细胞命运(pdf下载)
最近,本课题组在肿瘤抑制蛋白p53的作用研究中取得重要进展,研究成果“Cell
Fate Decision Mediated by p53
Pulses”发表在《美国科学院院刊》(PNAS
106,12245(2009))上。
当机体细胞受到来自外界的生存压力而产生DNA损伤时,细胞会通过一系列动力学过程对损伤作出响应,从而避免机体组织产生病变的危险。在这个过程中,肿瘤抑制蛋白p53发挥着关键性的作用。在正常情形下,细胞内的p53会被它的负调控因子抑制而处于一个很低的水平。当DNA损伤产生后,p53会被上游信号
激活而积累起来。被激活的p53作为转录因子可以调节大量下游基因的表达,这些基因表达的产物可能导致细胞周期阻断,从而为DNA修复提供便利。损伤较轻
的细胞在修复完成后可存活,而那些由于损伤严重而无法有效修复的细胞则会启动自杀性的凋亡程序,维护基因组的完整性。所以,p53通过调控细胞周期阻断、
DNA修复和凋亡过程,从而实现对DNA损伤响应过程的有效控制。然而,有关p53如何调控细胞命运的具体机制仍不清楚。特别地,最近实验发现了p53浓
度能以周期性脉冲的形式变化,这将会对细胞命运抉择有何影响?
本课题组构建了一个p53对DNA损伤响应的动力学理论模型。该模型整合了DNA损伤的产生和修复模块、损伤感知模块、p53振荡模块和细胞命运抉择模块,深入刻画了p53信号网络对DNA损伤响应的整个过程。
我们提出p53会促进轻度损伤细胞的DNA修复,而抑制严重损伤细胞的DNA修复,并运用统计物理和非线性动力学理论开展了系统研究。结果表明,损伤细胞的命运是由所产生的p53脉冲的数目决定的。当损伤程度较轻时,p53可诱发短暂的细胞周期阻断,并能使细胞在修复完成后继续存活。而当损伤较为严重时,持续的p53脉冲足以诱发细胞凋亡。这些结果与实验数据和观测一致,并进一步给出相关的理论预言。该工作阐明了p53协调实现DNA修复和细胞命运抉择的一个动力学调控机制。这些研究对人们了解p53抑制肿瘤产生的功能具有重要的意义。

(2010.1)
细胞内拥挤环境中蛋白质折叠与二聚化过程研究取得最新进展(pdf下载)
最近,本课题组与美国、法国和以色列的三位专家合作,在蛋白质折叠和二聚化的热力学和动力学方面取得了重要进展。我们共同提出了一个模拟蛋白质分子在拥挤环境下细胞内的二聚化模型,利用中间精度蛋白质模型的分子动力学计算模拟,研究了蛋白质分子链的扩散和二聚化过程,相关结果发表在《美国科学院院报》(Proc.
Natl. Acad. Sci. USA,106,5517,
2009)上。
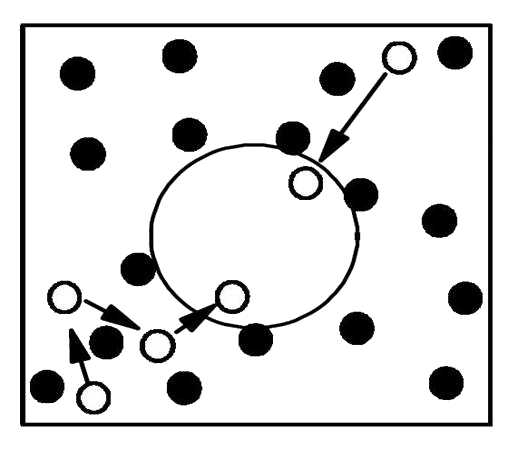
蛋白质特有的天然态折叠结构是其行使生物功能的生物物理基础,蛋白质折叠是生物学中心法则中至今仍未完全解决的一个重要环节,特别是在真实细胞拥挤环境中,蛋白质分子自组装折叠、聚集及其生物功能实现的动力学过程和物理机制还很不清楚。我们用球柱形约束模拟细胞拥挤环境(球柱尺寸与系统有效分子浓度相关),构建了一个蛋白质折叠和二聚化的理论模型,首次研究了典型的二聚体蛋白质Arc
Repressor
的二聚化过程,很好地解释了相关实验工作。我们细致刻画了拥挤特性对该蛋白质二聚化过程的动力学和热力学的影响,在理论上得出了蛋白质二聚化过程的速率与分子拥挤浓度的关系,发现扩散与聚合最快速率对应的有效分子浓度在量级上对应于细胞真实环境中生物分子拥挤浓度。此结果定性刻画了细胞中分子浓度与蛋白质二聚化动力学的优化关系。基于聚合物高分子理论,进一步发现二聚蛋白的折叠和聚合相对应的势垒高度和热力学稳定性与约束空间尺度和折叠温度之间具有很好的标度关系,揭示了二聚蛋白的折叠和聚合能够用能量面漏斗理论描述。此项研究为揭示真实细胞中蛋白质功能结构形成与功能的关系、蛋白质-蛋白质相互作用和理解酶的催化机理有着重要的理论意义。
(左图:蛋白质二聚化的扩散和绑定模型;右图:模型蛋白质的二聚化速率与浓度关系)
(2009.12)
|